Микроспоридиозы у сезонных killi
Рыбы являются хозяевами для более чем 150 видов микроспоридий, относящихся к 14 родам [Lom J., 2002]. Микроспоридии – это одноклеточные организмы из царства Грибов, являющиеся облигатными внутриклеточными паразитами животных. Необходимость внутриклеточного паразитирования обусловлена отсутствием у них митохондрий и ряда других органелл. Поэтому вне клеток хозяина микроспоридии существуют только в виде спор, содержащих один-два зародыша и уникальный комплекс органелл – аппарат экструзии. Последний предназначен для заражения клетки хозяина путем прокола ее оболочки и вбрасывания зародышей непосредственно в цитоплазму. В клетке микроспоридии подвергается пролиферативному циклу (merogony) и, в конечном счете, формированию спор (sporogony). Т.е. налицо довольно простой жизненный цикл без промежуточных хозяев.
Наиболее распространены микроспоридии среди членистоногих и рыб. У сезонных икромечущих карпозубых до настоящего времени описано лишь два вида микроспоридий – Glugea anomala и Nucleospora secunda. У несезонных killi так же обнаружено несколько видов микроспоридий, но их описание выходит за рамки данной заметки. Для хобби наибольшую актуальность имеет обнаружение ксенома-образующих родов и видов (в отношении других любитель просто не поймёт, что имеет дело с микроспоридиозом), поэтому в приложении №1 содержится ключ к их определению.
Род Glugea Thelohan, 1891
Glugea anomala (Moniez, 1887)
Этот вид глюгеи является типичным паразитом трёхиглой (Gasterosteus aculeatus) и девятииглой (Pungitius pungitius) колюшек. Так же это единственный вид глюгеи, описанный у сезонных икромечущих карпозубых. Достоверно доказано поражение Glugea anomala лишь у двух видов нотобранхиусов: Nothobranchius eggersi и N. korthausae. Так же предполагается, что аналогичная инфекция обнаружена ещё у Fundulopanchax filamentosus и Auastrolebias nigripinnis [Lom J. et al., 1995]. Кроме того, ниже я представлю свои наблюдения глюгеоза, где предполагаю Glugea anomala в качестве этиологического агента у Fundulopanchax deltaensis и N. polli.
Несложно заметить, что ареалы распространения этих четырёх групп рыб, мягкого говоря, не очень пересекаются. При этом, все документально зафиксированные случаи заболевания killi были зарегистрированы у рыб, живущих в неволе. Это наводит на мысль, что данный паразит не характерен для природных популяций, а спонтанное заражение происходит уже в неволе. В общем-то это не единственный пример того как паразит находит себе новых хозяев при смене места обитания. Остаётся вопрос: Как глюгея попадает в наши аквариумы? Моё предположение сводится к тому, что это происходит с живыми кормами. Например, с плохо промытым лиманным мотылём т.к. география добычи “южного” мотыля пересекается с географией распространения колюшек. Но это только предположение. Живой корм, вероятно, не включен в жизненный цикл паразита. Передача спор с кормом чисто механическая, поэтому и происходит довольно редко. Подобный механизм показан для Glugea stephani, которую способны переносить бокоплавы и ракообразные, и для Tetramicra brevifilum, которую способны переносить веслоногие рачки, мизиды и личинки десятиногих раков [в качестве обзора см. Lom and Dykova, 2005].
Независимо от характера источника инфекции, рыбы на первом этапе поглощают споры паразита. Входными воротами инфекции являются верхние отделы желудочно-кишечного тракта. Поэтому первые ксеномы можно обнаружить в стенке начальных отделов кишки. Дальнейшее распространение паразита происходит при помощи клеток иммунной системы: макрофагов, нейтрофилов или интраэпителиальных Т-лимфоцитов, которые расселяются по соединительнотканным прослойкам различных органов (почки, селезёнка, яичники, глаза), а так же по брюшине, в стенке плавательного пузыря и подкожной соединительной ткани. В этих местах и происходит образование ксеном. Какие конкретно клетки организма хозяина трансформируются под воздействием паразита в ксеномы не очень понятно. Однако доказана способность ряда микроспоридий начинать цикл деления уже в клетках иммунной системы, циркулирующих в крови рыб. В дальнейшем эти клетки оседают в местах окончательной дислокации, где и происходит формирование ксеном [Lom and Dykova, 2005].
Ксенома – это клетка организма хозяина с полностью перестроенной структурой в результате пролиферации паразита (микроспоридий) внутри неё. При этом оба компонента настолько морфологически и физиологически интегрированы, что формируют уникальную единицу, относительно самостоятельно развивающуюся в организме хозяина. Макроскопически ксеномы выглядят как белые овальные узелки длинной до 1 мм, образующие узловые скопления диаметром до 1 см (рис. 1).

Рис. 1. Самка Fundulopanchax deltaensis с многочисленными подкожными скоплениями ксеном. Время от момента появления первых видимых узелков ~ 2.5 месяца. Видны скопления ксеном в области глаз, под кожей брюшной полости, в мышцах хвостового стебля. В скоплении под глазом видна прорвавшаяся наружу ксенома (тёмное пятно).
Микроскопически (см. рис. 2.) у ксеном Glugea anomala клеточная мембрана многослойная, многодольчатые ядра смещены к периферии клетки, где находятся так же периферические везикулы, в которых паразит проходит все фазы пролиферативного цикла и происходит образование спор. Споры накапливаются в центральной части ксеномы. Каждая индивидуальная ксенома – это одна клетка. До заражения её диаметр приблизительно равен 6-8 мкм, а на финальных стадиях инфекционного процесса может доходить до 1мм, т.е. увеличивается более чем в 100 раз! На финальной стадии ксенома разрушается и споры выходят либо в ткани животного, либо во внешнюю среду. При выходе в ткани они подвергаются фагоцитозу макрофагами, часть из которых заражается и, в свою очередь, трансформируется в ксеномы. Выделение спор во внешнюю среду происходит в результате разрывов подкожных ксеном.
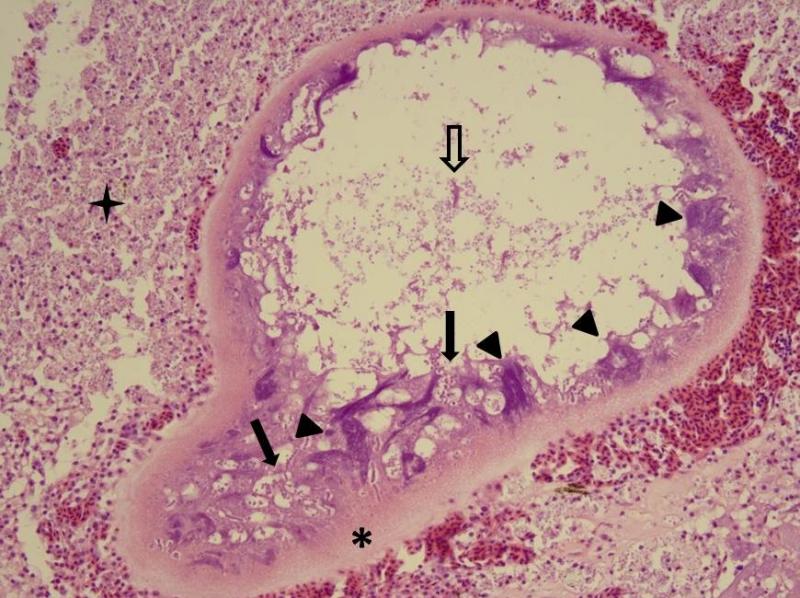
Рис. 2. Ксенома, предположительно образованная Glugea anomala. Многослойная клеточная мембрана (звёздочка), многодольчатые периферически расположенные ядра (треугольники), периферические везикулы с различными фазами пролиферативного цикла (заполненные стрелки), центрально расположенное скопление спор (полая стрелка); последняя стадия развития ксеномы – разрушенная ксенома: споры лежат среди полей пенистых клеток и наблюдаются внутри них (четырёхконечная звёздочка).
Конкретный сценарий развития инфекционного процесса зависит не только от свойств паразита, но и от свойств хозяина. Характер развития инфекционного процесса во многом определяется состоянием и возрастом рыб на момент заражения. Вероятно, чем в более раннем возрасте происходит инфицирование, тем более латентное течение приобретает инфекция. Кроме этого, у молодых рыб наблюдается значительная гетерогенность степени выраженности поражения. Так у одних молодых N. polli можно было наблюдать единичные ксеномы в исследованном материале, а у других особей того же возраста десятки ксеном в том же объёме материала. Точное время инфицирования моих N. polli не известно, однако в 4-х месячном возрасте инфекция уже была обнаружена – стало очевидным замедление роста, раз в месяц погибало по одному нотобранхиусу в общем аквариуме, некоторые особи становились “ползунами”. При вскрытии на кишечнике были обнаружены “молодые” ксеномы длинной менее 1 мм. В пятимесячном возрасте я начал забой рыбы для исследований. У всех исследованных рыб были найдены ксеномы в стенке кишечника (рис. 3), а так же в облитерированном плавательном пузыре у "ползунов" (рис. 4).
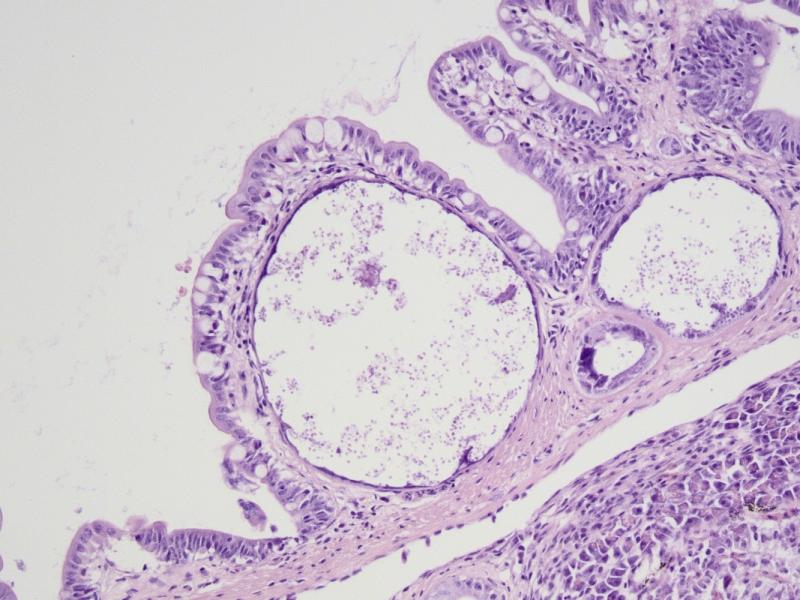
Рис. 3. Ксеномы в позслизистой и мышечной оболочках стенки кишки у N. polli, самка.
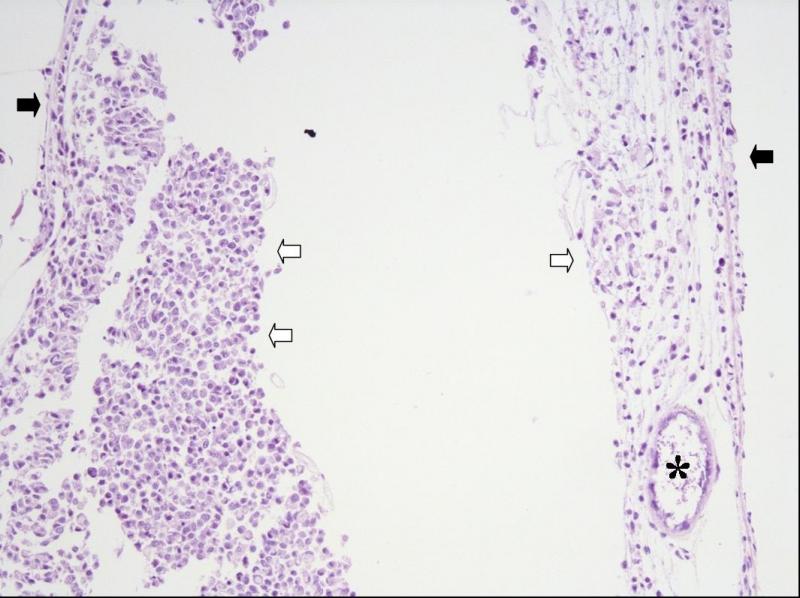
Рис. 4. Облитерация полости плавательного пузыря у N. polli, самец. Стенки пузыря (чёрные стрелки). Ксенома в просвете пузыря (звёздочка). Скопление макрофагов в просвете пузыря (полые стрелки).
Подытоживая, можно выделить некоторые клинические проявления, которые, хотя и не позволяют поставить диагноз, но однако дают возможность заподозрить наличие инфекции. К сожалению, это неспецифические симптомы: отставание в развитии, внезапная смерть некоторых особей (не обязательно самых маленьких и слабых, а чаще даже наоборот – самых крупных), нарушение функции плавательного пузыря (подросток становится “ползуном”). К специфическим симптомам относится появление подкожных ксеном, что происходит в основном у пожилых иммуноскомпрометированных рыб. В этой ситуации мы можем не один раз успеть собрать икру от заражённой рыбы до обнаружения очевидных клинических признаков болезни.
Несмотря на высокую контагиозность глюгеоза, последствия инфицирования естественно разные для колюшек в природе и карпозубых в аквариуме. Заражённые колюшки чаще сбиваются в стаи и формируют стаи более крупных размеров, чем незаражённые. Это резко увеличивает вероятность атаки хищников (чаек). При этом заражённые особи занимают лидирующее поражение в стае. При стайном существовании паразит, несомненно, выигрывает, т.к. во время атак возрастает вероятность разрыва подкожных ксеном и выделения спор. Так же есть предположение, что споры Glugea anomala могут неизменными проходить через желудочно-кишечный тракт чаек (как это доказано для Myxobolus cerebralis), и тем самым опять же увеличивается их количество в окружающей среде [Ward A. et al., 2005]. Однако, несмотря на всё это, процент поражённых особей далёк от 100%.
У сезонных killi в аквариуме, при почти 100% заразительности и летальности, инфекция развивается довольно медленно (месяцы) т.к. подкожные ксеномы способны достигать довольно крупных размеров (1 мм) прежде чем произойдёт прорыв и выделение спор во внешнюю среду. Поэтому получение икры от заражённых особей до появления видимых подкожных ксеном и их разрывов вполне возможно. Усложняет ситуацию то, что Glugea anomala была обнаружена в яичниках рыб. Теоретически возможно выделение спор из половых путей при нересте и их адгезия на поверхности икринок и частичек торфа до появления первых видимых симптомов болезни. Таким образом встаёт вопрос о вертикальном переносе инфекции [Dunn and Smith, 2001], и проблема дезинфекции икры становится довольно актуальной.
Лечение и профилактика глюгеоза
Существует довольно мало литературных данных по лечению и профилактике глюгеоза, вызванного Glugea anomala, однако те что есть несколько обнадёживают. Следует правда оговориться, что все данные, опубликованные в реферируемых журналах, касаются трёхиглой колюшки и штаммов глюгеи, выделенных непосредственно из них.
Препараты хлора. Препараты хлора давно и достаточно успешно применяются для дезинфекции (профилактики) при микроспоридиозах. Наибольшее распространение они находят в научных лабораториях, использующих данио (Danio rerio) и медаку (Oryzias latipes) в качестве модельных животных для исследования ранних стадий эмбрионального развития. Микроспоридиозы данио вызваны Pseudoloma neurophilia, поражающей нервную ткань с развитием энцефалитов и менингитов, и мышечную ткань с развитием тяжёлых хронических миозитов. Pseudoloma neurophilia так же часто поражает яичники данио (до 10 000 спор в одном яичнике!). Однако внутри икринок споры обнаруживаются редко. Поэтому предполагается, что передача инфекции потомству осуществляется в процессе спаривания. Споры выделяются из половых путей самки и “налипают” на икру, что и приводит к необходимости её дезинфекции [Ferguson J. et al., 2007].
Дезинфицировать икру принято раствором гипохлорита натрия (NaOCl) с концентрацией свободного (активного) хлора 25 ppm (это 0.025% или 25 мг/л) в течении 10-15 мин. Однако если свободный хлор в такой концентрации уничтожает > 75% спор Pseudoloma neurophilia, то в отношении Glugea anomala он куда менее эффективен (уничтожает < 20% спор при тех же условиях). Даже после обработки спор Glugea anomala раствором гипохлорита натрия с концентрацией свободного хлора 3000 ppm в течении 40 мин, 1% из них не теряет жизнеспособность [Ferguson J. et al., 2007]. Поэтому применение стандартных схем дезинфекции икры, эффективных для предотвращения вертикального переноса микроспоридий у данио и медаки, вероятнее всего, окажутся неэффективными у сезонных killi. Тут надо искать другие походы.
Фумагилин (fumagillin). Ранее этот препарат применялся для лечения некоторых микроспоридиозов. Однако смертность рыб в результате токсичности препарата в терапевтической концентрации была так велика, что мы рассматривать этот метод в пределах данной публикации не будем.
Производные бензимидазола (albendazole, mebendazole, fenbendazole). Изначально альбендазол начал применяться для лечения микроспоридиозов у иммунокомпрометированных людей. В дальнейшем была показана эффективность всех трёх производных бензимидазола при лечении пресноводной формы трёхиглой колюшки, инфицированной Glugea anomala в естественной среде обитания [Schmahl and Benini, 1998].
Схема, при которой был достигнут выраженный терапевтический эффект выглядела следующим образом. В 10 литровый контейнер с отстоянной водой добавлялся раствор альбендазола (или метабендазола, или фенбендазола) до финальной концентрации 2 мг/л. Т.к. производные бензимидазола плохо растворяются в воде, то сначала препараты растворялись в диметилсульфоксиде (DMSO). В аквариуме с лекарством рыбы выдерживались по схеме: 6 часов в препарате + 36 часов в чистой воде. И так три раза. После этого заразительность спор, выделенных из ксеном, падала в 5-10 раз. Аналогичным эффектом на развитие паразита обладала однократная инкубация в препарате с концентрацией 50 мг/л в течении 6 часов. Однако в экспериментах по токсичности препарата установлено, что рыбы способны выдерживать 50 мг/л любого из трёх препаратов в течении 100 часов без видимых последствий, как морфологических, так и поведенческих [Schmahl and Benini, 1998]. Исходя из этих экспериментов можно предположить, что лечение на ранних стадиях путём содержания инфицированной рыбы в аквариуме с 2-20 мг/л альбендазола в течении 3-4 дней может привести к полному излечению глюгеоза.
Толтразурил (toltrazuril). Наиболее эффективной схемой является 2мг/л – 3 раза по 6-24 часа с суточным перерывом между ними [Schmahl G. et al., 1990].
Род Nucleospora Hedrick, Groff and Baxa, 1991
Nucleospora secunda Lom & Dykova, 2002
Микроспоридии рода Nucleospora так же являются типичными внутриклеточными паразитами. Однако, в отличие от рода Glugea, их местом размножения являются ядра клеток кишечного эпителия (энтероцитов). До настоящего времени описан только один вид Nucleospora (Nucleospora secunda) у одного вида нотобранхиусов (Nothobranchius rubripinnis) [Lom and Dykova, 2002].
В ядрах энтероцитов проходит весь цикл размножения Nucleospora secunda от меронтов до зрелых спор. Ассоциация с вирусной инфекцией не обнаружена. К сожалению ни клиническая картина, ни вирулентность, ни летальность паразита, ни способы лечения в единственной оригинальной публикации не отражены. Сообщается только, что материал взят у продавца природной рыбы, который купил её у другого экспортёра, который, в свою очередь, ввёз рыбу из Танзании.
Благодарности
Выражаю свою глубокую благодарность Максиму Аксёнову за ценные критические замечания и помочь в подготовке к публикации на сайте.
Литература
Dunn A. and J. Smith 2001 Microsporidian life cycles and diversity: the relationship between virulence and transmission. Microbes and Infection, 3: 381–8.
Ferguson J. et al. 2007 Spores of two fish microsporidia (Pseudoloma neurophilia and Glugea anomala) are highly resistant to chlorine. Dis. Aquat. Org, 76: 205–214.
Lom J. 2002 A catalogue of described genera and species of microsporidians parasitic in fish Systematic Parasitology, 53: 81–99.
Lom J. et al. 1995 Occurrence of a microsporean with characteristics of Glugea anomala in ornamental fish of the family Cyprinodontidae. Dis. Аquat. Org, 21: 239–242.
Lom J. and I. Dykova 2002 Ultrastructure of Nucleospora secunda n. sp. (Microsporidia), parasite of enterocytes of Nothobranchius rubripinnis. Europ. J. Protistol, 38: 19–27.
Lom J. and I. Dykova 2005 Microsporidian xenomas in fish seen in wider perspective. Folia Parasitologica, 52: 69–81.
Schmahl G. and J. Benini 1998 Treatment of fish parasites. 11. Effects of different benzimidazole derivatives (albendazole, mebendazole, fenbendazole) on Glugea anomala Moniez, 1887 (Microsporidia): ultrastructural aspects and effcacy studies. Parasitol. Res, 84: 41-9.
Schmahl G. et al. 1990 Transmission electron microscopic studies on the effects of toltrazuril on Glugea anomala Moniez, 1887 (Microsporidia) infecting the three-spined stickleback Gasterosteus aculeatus. Parasitol. Res, 76: 700-6.
Ward A. et al. 2005 Shoaling behaviour of sticklebacks infected with the microsporidian parasite, Glugea anomala. Environmental Biology of Fishes, 72: 155–160.
ПРИЛОЖЕНИЕ №1. Ключ к определению ксенома-образующих родов микроспоридий рыб [по Lom J., 2002 с изм.].
1а. Микроспоридии развиваются в ядрах клеток хозяина. Споры в основном не более 2 мкм в длину...Nucleospora
1б. Микроспоридии развиваются в цитоплазме клеток хозяина...2
2а. Развитие и формирование спор происходит в мелких или крупных ксеномах, выглядящих как небольшие белесоватые узелки...3
2б. Паразит не вызывает формирование ксеном...12
3а. Ксеномы локализуются в нервной ткани...4
3б. Ксеномы локализуются в других типах тканей...5
4а. Ксеномы формируются из гипертрофированных до размера 1.5 мм ганглионарных клеток; споры двух типов...Spraguea
4б. Ксеномы размером до 200 мкм локализованы в спинном и заднем мозге; споры одного типа...Pseudoloma
5а. Присутствует два типа ксеном: маленькие (до 200 мкм) компартментализованные и огромные (до 4 мм) неразделившиеся...Ichthyosporidium
5б. Ксеномы другого типа...6
6а. Полярная трубка, по форме напоминающая твёрдую рукоятку, видна в свежих спорах или после экструзии...Microfilum
6б. Полярная трубка длинная, тонкая и гибкая...7
7а. Споры с крупными включением в задней вакуоли; многочисленные плотно лежащие ксеномы формируют белёсые узелки...Tetramicra
7б. Споры без таких включений в задней вакуоли...8
8а. Первые стадии мерогоний с диплокарионом...Neonosemoides
8б. Диплокарионы не формируются процессе развития...9
9а. Стенка ксеном покрыта коллагеновыми волокнами, присутствуют мерогонийные и спорогонийные плазмодиев...Nosemoides
9б. Стенка ксеном другого типа...10
10а. На поверхности простой плазмалеммы ксеном микроворсинки, многоядерные меронты расположены внутри расширенных цистерн эндоплазматического ретикулума клетки хозяина...Microgemma
10б. Ксеномы имеют толстую стенку...11
11а. Стенка ксеномы образована несколькими плотно упакованными слоями клеточной мембраны; многодольчатые ядра клетки хозяина расположены в периферических отделах ксеномы; споры развиваются внутри спорофорных везикул, которые индуцирует паразит в периферических отделах ксеномы...Glugea
11б. Стенка ксеномы состоит из гранулярно-фибриллярного слоя; гипертрофированные ядра клетки хозяина расположены центрально; паразиты на разных стадиях развития перемешаны со спорами внутри ксеномы...Loma
12. ...
- Блог пользователя Никита Савёлов
- Для комментирования войдите или зарегистрируйтесь
Новые обсуждения форума
- Группы в месенджерах
- Выставки Killi в 2025 году (РЕЗУЛЬТАТЫ)
- Предновогодняя встреча 2024.
- Выставки Killi в 2024 году (РЕЗУЛЬТАТЫ)
- Февральская встреча 9 числа
- Поздравляем!
- Астролебиасы (Austrolebias)
- Лягушатники - тоже люди?
- Выставки Killi в 2023 году (РЕЗУЛЬТАТЫ)
- Sergejam Dzim?anas Diena!
- "Моно" аквариум самосевом.
Активные обсуждения форума
- Группы в месенджерах
- Выставки Killi в 2025 году (РЕЗУЛЬТАТЫ)
- Продам эпиплатис Дагета .
- Предновогодняя встреча 2024.
- "Моно" аквариум самосевом.
- Выставки Killi в 2024 году (РЕЗУЛЬТАТЫ)
- Общая выставка с нашим участием.
- Февральская встреча 9 числа
- Сведения о биотопах
- Александр Сухов с днём рождения!
- Поздравляем!
Новые записи в блогах
- Всем привет. Немного психотерапии для нашего сообщества
- Epiplatys dageti
- Один из способов фотографирования килли
- Fundulopanchax walkeri spurelli
- N. Rachovii
- Aphyosemion australe фото дня
- Fundulopanchax gardneri "Gold" фото дня
- Аквариумные Аплохейлусы
- Разведение Fundulopanchax gardneri nigerianus
- Про выставку аквариумных рыб


Комментарии
Отличная статья! :THUMBS
CCCP, г.Челябинск
ДАА,Сильно!
В раздел "Здоровье рыб" ее,с пометкой "Важно".
Побочий Андрей
28.01.2012 Добавил пару картинок и немного текста про ранние клинические проявления глюгеоза.
Никита! Поясни пожалуйста: концентрация лекарств 2 мг/мл? или это опечатка?
Конечно опечатка. Исправил.
Хоть кто-то прочитал внимательно.